

中国北京,2025年11月26日——甘李药业股份有限公司(以下简称:甘李药业,股票代码:603087.SH)宣布公司自主研发的胰高血糖素样肽-1受体激动剂(GLP-1RA)博凡格鲁肽(研发代号:GZR18)注射液正式启动一项针对肥胖或超重适应症的III期临床试验(GRADUAL-3),这是博凡格鲁肽在肥胖/超重领域开展的第三项大规模III期临床研究。该研究将采取每四周一次皮下注射给药的月制剂方案,旨在探索博凡格鲁肽注射液在控制和维持体重方面的临床潜力。
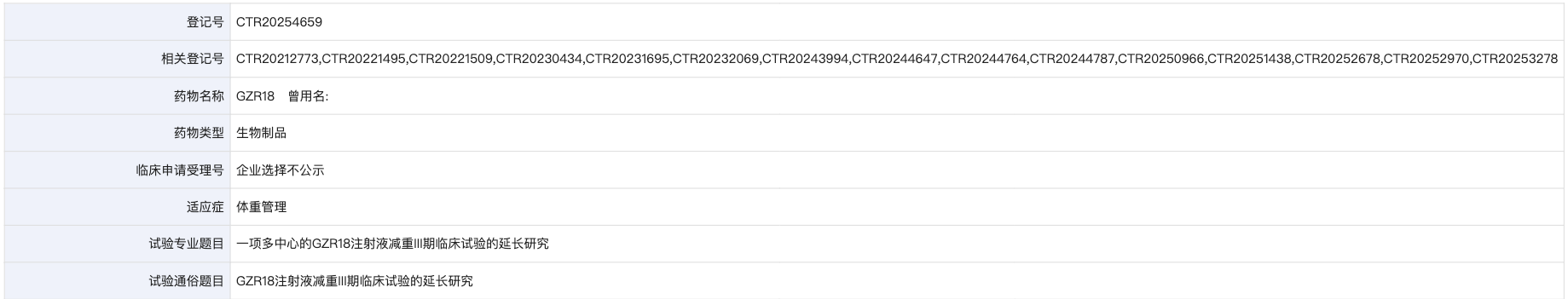
药物临床试验登记与信息公示平台登记官网信息
突破性月制剂方案有望提升治疗便捷性
本研究(药物临床试验登记与信息公示平台:CTR20254659)旨在探索博凡格鲁肽注射液在每月一次给药情况下,连续治疗24周后对体重的影响和安全性。研究由北京大学人民医院的纪立农教授担任牵头研究者,研究的主要终点为治疗24周后体重较基线的变化和变化百分比。
此前,针对肥胖或超重适应症,甘李药业已启动了两项III期临床研究(GRADUAL-1和GRADUAL-2)。在GRADUAL-2研究中,博凡格鲁肽注射液为全球首个在合并或不合并2型糖尿病的中国成年肥胖/超重受试者中与诺和盈®(司美格鲁肽2.4mg)进行头对头平行对照研究的GLP-1RA,旨在全面评估和验证博凡格鲁肽注射液在肥胖或超重患者的疗效和安全性,并评估其对不同代谢指标与心血管风险因素的综合改善能力。本次启动的III期临床研究(GRADUAL-3)将进一步探索博凡格鲁肽注射液每月一次给药控制和维持体重的潜力,以期通过更低的注射频次、更为便捷的治疗方式提高患者用药依从性,改善GLP-1RA药物长期治疗后体重反弹和疗效欠佳的现状。
GRADUAL系列临床研究项目全速推进
GRADUAL系列研究是博凡格鲁肽注射液针对肥胖或超重适应症开展的大规模III期临床研究,皆在全面评估博凡格鲁肽注射液在超重/肥胖人群中的治疗效果及安全性。目前在中国开展的III期临床试验包含3项,预计共纳入超1000例成年肥胖或超重受试者。
GRADUAL-1研究:为期52周,在630例经饮食运动体重控制不佳的中国成年肥胖/超重受试者中,评估博凡格鲁肽的减重疗效和安全性;
GRADUAL-2研究:为期52周,在471例经饮食运动体重控制不佳的合并或不合并2型糖尿病的中国成年肥胖/超重受试者中,评估博凡格鲁肽对比减重版的司美格鲁肽(诺和盈®,2.4mg规格)的减重疗效与安全性;
GRADUAL-3研究:为期24周的延长临床研究,探索每月一次博凡格鲁肽注射治疗对体重的影响和安全性。
关于博凡格鲁肽注射液
甘李药业自主研发的博凡格鲁肽(研发代号:GZR18)注射液临床开发适应症目前包括肥胖/超重,2型糖尿病两项。临床研究数据显示博凡格鲁肽能有效减轻体重和降低血糖,并综合改善其他代谢相关指标,安全性和耐受性特征与已上市GLP-1RA类药物一致。目前,博凡格鲁肽注射液的全球开发已进入III期临床研究阶段。
前瞻性声明
该前瞻性陈述基于我们在陈述之日的预期和假设。由于各种因素,实际结果可能与这些前瞻性陈述中表达的内容存在重大差异,我们不能保证将来会实现这些结果。我们不承担更新或修改任何前瞻性陈述的义务,无论是由于新信息、未来事件或其他原因。
关于甘李药业
甘李药业股份有限公司(简称:甘李药业,股票代码:603087.SH)作为中国第一家掌握产业化生产重组胰岛素类似物技术的高科技生物制药企业,具备完整胰岛素研发管线。
目前,公司拥有六款核心胰岛素产品,包括五个胰岛素类似物品种:长效甘精胰岛素注射液(长秀霖®)、速效赖脯胰岛素注射液(速秀霖®)、门冬胰岛素注射液(锐秀霖®)、预混精蛋白锌重组赖脯胰岛素混合注射液(25R)(速秀霖®25)、门冬胰岛素30注射液(锐秀霖®30);以及人胰岛素品种:预混精蛋白人胰岛素混合注射液(30R)(普秀霖®30),产品覆盖长效、速效、预混三个胰岛素功能细分市场。同时,公司产品覆盖相关医疗器械,包括可重复使用的胰岛素注射笔(秀霖笔®)和一次性注射笔用针头(秀霖针®)。
在 2024 年中国胰岛素接续采购中,甘李药业的胰岛素类似物集采协议量在所有中选企业中排名第一。公司的国际化进程也在不断推进,一次性注射笔用针头(秀霖针®)在2020年获得美国食品药品管理局(FDA)批准。同时,2024年公司通过了欧洲药品管理局(EMA)的 GMP 检查。这标志着公司在国际和国内市场上的竞争力得到大幅提升。
未来,甘李将努力实现糖尿病治疗领域的全面覆盖,进一步提升公司在糖尿病治疗领域的市场竞争力。公司还将积极开发新的化学药和生物新药,重点关注代谢性疾病、心血管疾病和其他治疗领域。