


中国北京/奥地利维也纳,近日——甘李药业股份有限公司(以下简称:甘李药业,股票代码:603087.SH)宣布,公司自主研发的基础胰岛素周制剂GZR4注射液与胰高血糖素样肽-1受体激动剂(GLP-1RA)双周制剂博凡格鲁肽(研发代号:GZR18)注射液在中国2型糖尿病(T2DM)患者中的II期临床研究结果在第61届欧洲糖尿病研究协会(EASD 2025)年会上以口头报告的形式展示。相关研究成果受到了国际学术界的广泛关注,并引发了与会专家的积极讨论。同时,甘李药业以此学术盛会之机,在奥地利维也纳成功召开首届内分泌全球顾问委员会(Global Advisory Board)会议,与多位国际权威专家共议甘李新药开发策略与全球化布局。
声明:
1. 博凡格鲁肽注射液和GZR4注射液为研究中的药品,尚未在任何国家获批上市。
2. 甘李药业不推荐任何未获批的药品/适应症使用。
国际舞台发声 多项口头报告彰显研发实力与国际认可
EASD年会是欧洲规模最大、最具影响力的糖尿病学术会议。在本届年会上,甘李药业多项II期临床研究结果由海内外顶级内分泌学专家以口头报告形式重磅展示:
甘李药业胰岛素周制剂GZR4注射液:在中国2型糖尿病患者中比较GZR4注射液与德谷胰岛素注射液(诺和达®)疗效和安全性的一项多中心、随机、开放、平行对照、达标治疗的II期临床研究
每周一次GZR4注射液与每日一次德谷胰岛素注射液在胰岛素经治的中国T2DM患者中糖化血红蛋白(HbA1c)降幅更优
治疗16周后,在基础胰岛素治疗血糖控制不佳的T2DM患者中,GZR4注射液组的HbA1c降幅显著优于德谷胰岛素注射液组(-1.26% vs -0.87%,p<0.01),且达到HbA1c<7.0%和HbA1c≤6.5%的受试者比例更高(52.1% vs 29.2%;25.0% vs 10.4%)。稳态时,GZR4组所需的周胰岛素摩尔剂量显著低于德谷胰岛素组(88.7 vs 218.2 U/周 [1 U= 6 nmol],p < 0.001)。两组治疗期间出现的不良事件发生率相似,试验期间未发生严重低血糖事件,未发生与试验用药品相关的严重不良事件。


该研究主要研究者、天津医科大学朱宪彝纪念医院陈莉明教授在会上口头报告GZR4 II期临床研究结果
每周一次GZR4注射液与每日一次德谷胰岛素注射液在胰岛素初治的中国T2DM患者中HbA1c降幅相当
治疗16周后,在口服降糖药治疗血糖控制不佳的T2DM患者中,GZR4注射液组与德谷胰岛素注射液组的降糖效果相当(HbA1c较基线变化均值分别为-1.50%和-1.48%,p=0.90;HbA1c<7.0%的受试者比例分别为59.5%和70.7%;HbA1c≤6.5%的受试者比例分别为38.1%和29.3%),但稳态时所需胰岛素周摩尔剂量明显较低(80.6 vs 165.8 U/周 [1 U= 6 nmol],p< 0.001)。在安全性方面,两组不良事件发生率相似,试验期间未发生严重低血糖事件,未发生与试验用药品相关的严重不良事件。


德国Profil Institute首席科学家、甘李药业顾问 Hans de Vries教授在会上口头报告GZR4 II期临床研究结果
GLP-1RA双周制剂博凡格鲁肽(GZR18)注射液:在中国2型糖尿病患者中评价博凡格鲁肽注射液与司美格鲁肽(诺和泰®)的疗效和安全性的一项多中心、随机、开放、阳性药物对照II期临床研究
治疗24周后,每两周一次(Q2W)12 mg、18 mg和24 mg博凡格鲁肽注射液组受试者HbA1c分别较基线降低1.87%、2.28%和 1.94%,每周一次(QW)24 mg组受试者HbA1c降低2.32%,降幅数值均高于司美格鲁肽组(-1.60%);其中18 mg Q2W组和24 mg QW组对HbA1c的改善显著优于司美格鲁肽组(p<0.001)*。在经生活方式干预血糖控制不佳的初治患者中,每两周一次18 mg组HbA1c较基线降幅高达2.98%,显著优于司美格鲁肽组(-2.04%;p<0.001)*。此外,各组博凡格鲁肽注射液组体重较基线平均降低4.26至6.54 kg,而司美格鲁肽组患者仅降低3.25 kg*。同时,博凡格鲁肽注射液还有效改善了空腹血糖、血压、血脂等指标,为糖尿病患者带来多重获益,且总体安全性和耐受性与其他GLP-1RA类药物一致。
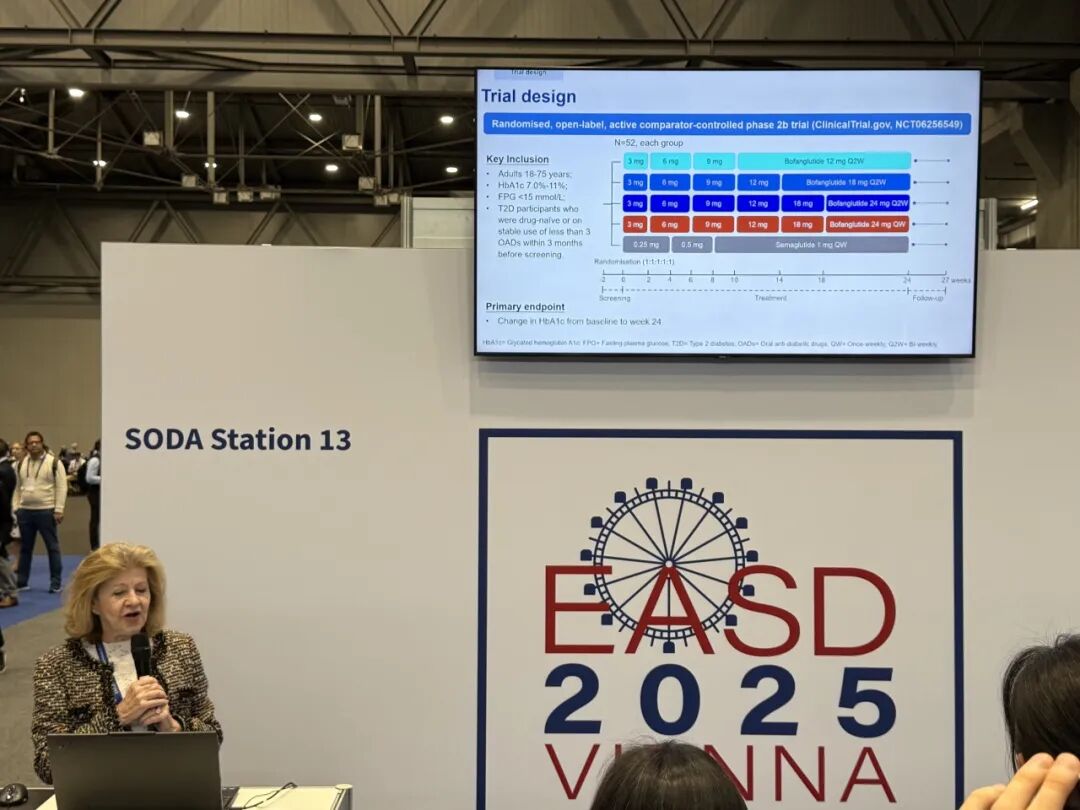
美国内分泌学专家、甘李药业顾问 Helena W. Rodbard 教授在会上口头报告博凡格鲁肽II期临床研究结果
*试验数据以均值形式表示
上述II期临床研究的详细结果将在同行评审期刊上发表。
汇聚全球智慧 甘李药业全球顾问委员会会议成功召开
甘李药业首届内分泌全球顾问委员会会议于奥地利维也纳成功召开,会议聚集了来自中国和欧美十余位内分泌领域的国际顶尖专家学者,共同研讨甘李药业代谢创新管线的全球开发策略。会议期间,甘李药业展示了公司新药取得的积极临床结果,并与专家就不同产品的海外开发方针进行了深入探讨,取得广泛共识。本次全球顾问委员会的召开,标志着甘李药业研发体系全球化进一步加强。公司创新药物研发正实现从“跟跑”向“领跑”的角色转变,并致力于成为全球公共卫生领域的“合作伙伴”。



会议现场
陈伟博士 甘李药业董事长兼CEO
甘李药业董事长兼CEO陈伟博士表示:“我们非常荣幸能够邀请到全球顶尖专家共同为甘李药业代谢管线的开发策略擘画蓝图。此次顾问委员会会议的成功召开为公司未来的国际化进程提供了重要指导。我们将继续秉持‘以患者为中心’的理念,致力于为全球患者提供更优质、更便捷的治疗选择。”
前瞻性声明
该前瞻性陈述基于我们在陈述之日的预期和假设。由于各种因素,实际结果可能与这些前瞻性陈述中表达的内容存在重大差异,我们不能保证将来会实现这些结果。我们不承担更新或修改任何前瞻性陈述的义务,无论是由于新信息、未来事件或其他原因。
关于甘李药业
甘李药业股份有限公司(简称:甘李药业,股票代码:603087.SH)作为中国第一家掌握产业化生产重组胰岛素类似物技术的高科技生物制药企业,具备完整胰岛素研发管线。
目前,公司拥有六款核心胰岛素产品,包括五个胰岛素类似物品种:长效甘精胰岛素注射液(长秀霖®)、速效赖脯胰岛素注射液(速秀霖®)、门冬胰岛素注射液(锐秀霖®)、预混精蛋白锌重组赖脯胰岛素混合注射液(25R)(速秀霖®25)、门冬胰岛素30注射液(锐秀霖®30);以及人胰岛素品种:预混精蛋白人胰岛素混合注射液(30R)(普秀霖®30),产品覆盖长效、速效、预混三个胰岛素功能细分市场。同时,公司产品覆盖相关医疗器械,包括可重复使用的胰岛素注射笔(秀霖笔®)和一次性注射笔用针头(秀霖针®)。
在 2024 年中国胰岛素接续采购中,甘李药业的胰岛素类似物集采协议量在所有中选企业中排名第一。公司的国际化进程也在不断推进,一次性注射笔用针头(秀霖针®)在2020年获得美国食品药品管理局(FDA)批准。同时,2024年公司通过了欧洲药品管理局(EMA)的 GMP 检查。这标志着公司在国际和国内市场上的竞争力得到大幅提升。
未来,甘李将努力实现糖尿病治疗领域的全面覆盖,进一步提升公司在糖尿病治疗领域的市场竞争力。公司还将积极开发新的化学药和生物新药,重点关注代谢性疾病、心血管疾病和其他治疗领域。